Intégrer la microscopie clinique dans le traitement des parodontites
Parodontologie Par Mark BONNER le 19-05-2021De nombreuses pratiques intègrent maintenant le microscope à contraste de phase dans leurs activités quotidiennes, tant en prévention qu’en suivi thérapeutique. Sans cet outil, plusieurs dénotent l’impression de naviguer un peu à l’aveugle lorsqu’il est question des traitements parodontaux.
Les signes cliniques sont importants, bien entendu, mais ils ne nous en apprennent pas beaucoup sur l’étiologie de la maladie, là où en tant que praticien nous pouvons avoir un réel pourvoir d’action. De plus, en se basant uniquement sur ce que l’on voit à la radiographie, un patient atteint d’une parodontite débutante pourra facilement glisser en parodontite avancée malgré les bonnes mesures d’hygiène accomplies.
Un examen de routine d’à peine quelques minutes (où l’on aura prélevé un échantillon de plaque créviculaire ensuite posé sous la loupe du microscope) permettra aisément de voir la flore initiale de la maladie et d’adopter la bonne approche de traitement en fonction des pathogènes en cause.
Une opportunité qu’il faut saisir
Pour tous les types de pratiques, la prévention des maladies parodontales tout comme les traitements parodontaux constitue une opportunité ; et encore plus face à l’implantologie et ses risques de péri-implantite.
D’abord, il faut comprendre qu’il s’agit d’une maladie pour laquelle on peut facilement détecter et prévenir le degré de pathogénicité, à condition d’utiliser la microscopie lors des rendez-vous de routine chez nos patients. Un survol rapide des poches parodontales, suivi d’un prélèvement tiré des 3 poches les plus profondes, donne un regard clair de l’activité lytique (ou non) de la maladie parodontale. La bonne nouvelle, c’est qu’on se procure maintenant un microscope de qualité hospitalière pour des coûts minimes et un rapport investissement sur gain de productivité plus qu’important.
Fig. 01 : l’organisation typique au cabinet. Courtoisie du Dr T. Raharison, Saint-Martin-de-Fontenay.
L’analyse du biofilm est rapide et relativement simple à codifier, à condition de maîtriser la grille des figures et morphotypes microbiens. Après avoir étudié et répertorié pendant plus de 30 ans le biofilm créviculaire des patients en santé puis de patients affectés par les parodontites, nous avons créé une clé d’identification facile à utiliser, incluant les cellules inflammatoires et les bactéries des groupes de Socransky(1). Il faut au praticien en général 3 minutes pour analyser le prélèvement puis déterminer l’index de progression de la maladie parodontale incluant l’activité des pathogènes et l’importance du processus inflammatoire en place.
La parodontie médicale, et plus spécifiquement le Protocole de traitement antiparasitaire des parodontites que nous enseignons depuis plus de 20 ans, donnera l’opportunité à tous les praticiens de guérir même les formes les plus sévères de parodontite (poches de plus de 7 mm et mobilités), sans aucune chirurgie ni douleur pour le patient. La guérison parodontale va permettre une reconstruction osseuse des défauts osseux verticaux et une réorganisation du sillon parodontal, ceci pour un équilibre complet de l’espace biologique comme à l’origine, malgré un parodonte restreint et sans aucune poche profonde anormale.
L’approche en trois étapes, à l’image des traitements médicaux déjà utilisés pour d’autres infections, a l’avantage d’être facile à intégrer dans la pratique d’un généraliste tout comme celle d’un spécialiste : d’abord désinfecter, ensuite détartrer dans un milieu sain puis finalement donner un temps de cicatrisation toujours en milieu commensal. L’investissement initial est faible et les outils thérapeutiques sont facilement accessibles, mais encore plus importants, le traitement devient prédictible. La participation de l’assistante, ou de l’hygiéniste, est possible pour plus du 2/3 des composantes du traitement et permet de multiplier le rendement du département d’hygiène. Diagnostiquer, soigner, puis guérir, voilà pour le dentiste et son équipe une perspective intéressante et productive, voire rassurante et empreinte de récompenses ! Pour l’assistante ou l’hygiéniste, elles sauront mettre en valeur leur talent de communicatrice lors de l’enseignement des techniques de désinfection et devenir des co-animatrices effectives de la guérison parodontale. Une salle aménagée et dédiée à l’hygiène constitue un réel atout pour l’enseignement des techniques, alors que le patient sera invité à reproduire les mêmes gestes que l’assistante dans sa bouche, devant le miroir.

Fig.02 : aménagement d’une salle d’hygiène. Courtoisie du Dr T. Raharison, Saint-Martin-de-Fontenay.
La maladie parodontale ne concerne pas que les bactéries
Dans nos facultés dentaires, nous sommes nombreux à avoir suivi un enseignement où la maladie parodontale n’était perçue que sur la base des bactéries ou des facteurs de risques sur lesquels nous n’avons que peu d’impact réel.
On comprend maintenant mieux que la plaque n’est pas une cause, mais plutôt une voie d’entrée et que dans certains cas, un patient peut simplement avoir davantage de plaque qu’un autre sans pourtant être malade. La vraie différence réside dans la qualité de cette plaque et l’ampleur de la réponse inflammatoire, deux phénomènes facilement détectables à la microscopie. Le biofilm et les cellules de défense sont à la base de l’infection parodontale. Les micro-organismes présents à la microscopie sont directement mis en cause : bactéries, protozoaires (l’amibe Entamoeba gingivalis(2,4) et le flagellé Trichomonas tenax(5) maintenant reconnus pathogènes par la littérature scientifique) et les fungi. La présence de ces différents pathogènes est un facteur clé qui déclenche la réaction inflammatoire et une réponse qui contribue à libérer des médiateurs de l’inflammation à l’origine de la destruction des tissus de soutien.
La parodontite est une véritable infection. Elle est bien sûr transmissible et dans les majorités des cas, regorge entre autres de protozoaires acquis dans le milieu, de type agressif et destructeur. Le terme de chronicité de la maladie parodontale ne doit plus faire partie du vocabulaire de l’équipe dentaire et doit être vivement remplacé par la pleine guérison parodontale. Entrevoir la maladie parodontale comme une véritable infection, au même titre que d’autres bien connues chez l’être humain (l’amibiase intestinale par exemple), transforme notre capacité à intervenir et obtenir des résultats cliniques prédictibles. Les infections s’éliminent grâce au contrôle des portes d’entées de la maladie, au retour d’une flore d’enfant et au contrôle effectif de l’environnement du patient et de son entourage familial.
Voici les trois concepts critiques dans le traitement de la maladie parodontale qui deviennent évidents pour le dentiste microscopiste :
• Les techniques mécaniques ne permettent pas d’éliminer le nombre des microbes pathogènes d’une façon suffisante pour arrêter la maladie. Ceci est une constatation scientifique de la biologie parodontale : la réduction temporaire de la charge des pathogènes ne les empêche pas de se multiplier à nouveau.
• Le saignement gingival et l’inflammation de la crevasse parodontale sont les piliers de la progression de la parodontite. Les globules rouges deviennent une véritable nourriture pour les microbes et les globules blancs détériorés, synonymes de pus, contribuent directement à la destruction de l’os basal. En éliminant ces deux facteurs, on ouvre implicitement la voie à la cicatrisation et la guérison parodontale.
• Sans gingivite, pas de parodontite. La parodontite n’a pas une prédilection « naturelle » pour les molaires. Elle touche les dents pour lesquelles le patient présente une difficulté à maintenir une hygiène appropriée ou les emplacements présentant des détériorations locales rendues malsaines pour le maintien d’une physiologie normale. Dans les 2 cas, les sites auront présenté des signes de gingivite avant-coureurs.
Cinq engagements pour une pratique parodontale axée sur la guérison et le succès
Quels sont donc les engagements que nous pouvons prendre comme praticiens afin de guider nos patients vers la santé ?
1 • S’engager à une communication simple et efficace en cas d’atteinte parodontale
Une évaluation parodontale simple avec un sondage initial couplé à la microscopie du microbiote parodontal conduit le patient à se questionner et prendre une décision rationnelle face à sa santé buccale et les répercussions sur sa santé générale. Des années sans parodontites représentent des années de plus de survie totale et de qualité de vie.
2 • Évaluer le biofilm au microscope de routine tout comme la radiographie pour les lésions carieuses
L’analyse du biofilm permettra, en complément de l’évaluation parodontale, de déterminer « l’état de santé » du microbiote parodontal du patient. Lorsqu’on détecte la présence de pathogènes, le praticien pourra expliquer au patient les mesures à prendre afin d’éviter que la situation ne devienne plus sévère. Et surtout, on pourra aisément expliquer au patient comment et pourquoi intervenir sur son hygiène quotidienne afin d’éliminer complètement les pathogènes impliqués !
3 • Sensibiliser et éduquer les patients atteints de maladie parodontale
Les études démontrent qu’environ la moitié de la population adulte sera atteinte par la parodontite. Si le cabinet dentaire moyen compte environ 1 400 patients adultes, 700 patients souffrent effectivement de parodontite à des degrés divers(6). Avec l’aide de son équipe soignante, le clinicien pourra aisément déterminer quels patients sont susceptibles d’être touchés par la maladie et proposer une évaluation complète, déterminante et ainsi offrir un plan de traitement approprié. Tous ces patients pertinemment informés pourront prendre la décision qui leur est personnelle sans être ni jugés ni confrontés ou manipulés. Ils auront le loisir de faire un choix informé et conséquent pour eux même.
4 • Identifier l’origine de l’infection
Lorsqu’un patient présente une parodontite active, le clinicien sera en mesure d’identifier l’origine de l’infection et de prévenir une possible réinfection :
• Membres de la famille touchés par la parodontite ?
• Présence d’animaux domestiques infectés à la maison ?
• Voyages conséquents dans les tropiques ? Eau souillée ?
Les maladies parodontales sont pratiquement toujours d’origine infectieuse. Il importe impérativement de s’intéresser aux habitudes de vie du patient. Les désordres systémiques peuvent certes avoir une influence, mais leur contrôle clinique reste faible. Nous avons peu de pouvoir comme dentiste sur la génétique du patient, son âge ou sur son niveau de stress. Mais nous pouvons efficacement intervenir sur ses habitudes de vie et son entourage immédiat.
5 • Traiter pour guérir
L’engagement à guérir un patient qui présente une maladie avancée est tout à fait possible lorsque l’on prend les moyens médicaux appropriés pour éliminer l’infection(7). Si l’on peut poser une réserve sur une dent en mobilité III, les stades du diagnostic I, II et III disparaitront assurément pour un état dit de santé parodontale prédictible en retrouvant un microbiote parfaitement sain et l’arrêt complet confirmé du processus inflammatoire. La maintenance est rendue facile après la phase active du traitement et la santé parodontale est confirmée par un microbiote sans pathogènes facile à observer sous l’œil du microscope !
Exemple de cas
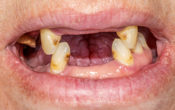
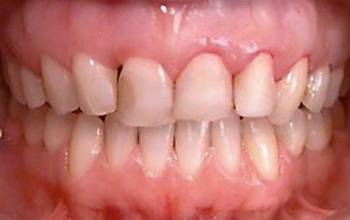
La patiente se présente au cabinet pour une deuxième opinion face à la proposition d’extraction des dents les plus touchées. Début quarantaine, non-fumeuse, problème de santé majeur du type fibromyalgique. Globalement, l’hygiène est bonne et elle ne présente que peu de tartre.
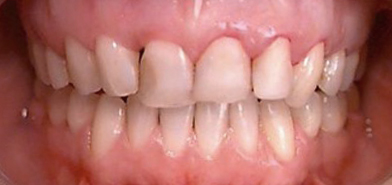
Fig. 03 : photographie prise avant le début du traitement.
Nous allons débuter l’examen parodontal complet. Au sondage, elle présente des poches profondes au niveau des centrales et des molaires. La centrale antérieure supérieure est mobile. Le saignement est présent sur une majorité de dents. La gencive est peu gonflée malgré tout. On perçoit les pertes osseuses verticales profondes sur plusieurs dents avec des poches à 9mm. Selon notre index, elle présente un score de 94, c’est-à-dire 94 mm de poches au-delà de 3 mm que nous souhaitons faire disparaître. Nous utiliserons les dents à 9 mm comme point de contrôle tout au long du traitement. C’est au fond de ces poches que nous prélèverons un échantillon du microbiote afin de suivre son évolution au cours de la thérapie.
On observe aisément la présence des globules blancs (ici des neutrophiles), des fusobactéries et des vibrions accompagnés d’une amibe immense à la microscopie.

Fig. 04 : le biofilm, avant traitement à 1000x. L’analyse du prélèvement confirme une amibiase active.
Parce que la patiente présente une forme avancée de type Sade III, grade C et mobilité dentaire, nous allons prescrire le métronidazole pour arrêter complètement l’infection et démarrer la désinfection locale efficace pour éviter toute réinfection subséquente.
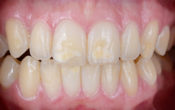
1 mois plus tard, au deuxième rendez-vous, la flore buccale a déjà complètement changé et l’œdème a disparu. L’engagement de la patiente est très bon, car elle perçoit aisément la différence : les saignements ont disparu, tout comme la rougeur, et même la mobilité des dents s’estompe.
La flore est immobile, les amibes ont disparu ainsi que les globules blancs. On constate l’absence des bactéries motiles et des leucocytes ce qui nous permet de penser que l’infection a disparu.
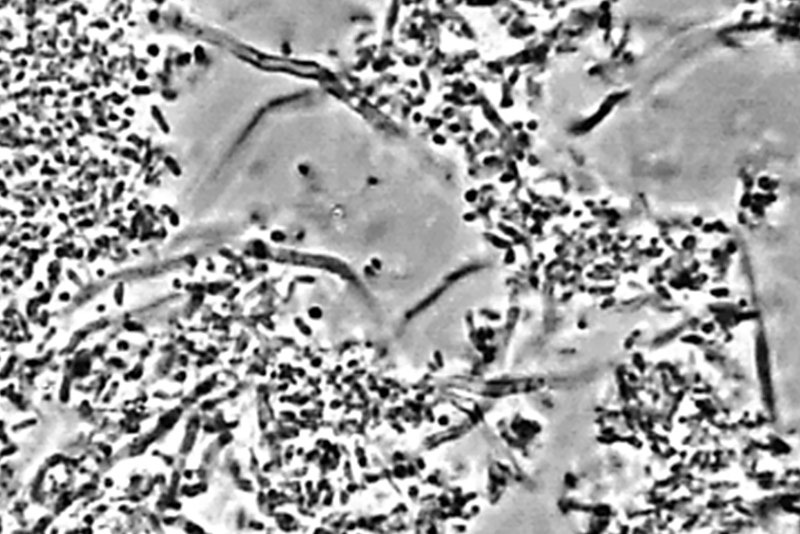
Fig. 05 : le biofilm, 1 mois après le début du traitement à 1000x.
À ce moment, nous lui présentons ce que nous appelons « le régime de maintenance », qui devra être adopté tout au long de la phase active du traitement puis en prévention si elle le souhaite, mais à un rythme beaucoup moins important par la suite. Ce régime repose essentiellement sur l’utilisation topique du peroxyde d’hydrogène à faible teneur et d’une poudre de bicarbonate salée. Il nous permettra d’éviter le retour de la charge microbienne pathogène.
À 2 mois, nous abordons la question des facteurs environnementaux afin d’identifier la source de l’infection surtout parasitaire (dans ce cas probable, les voyages dans les tropiques où l’eau est contaminée). La gestion de l’environnement est cruciale afin d’éviter les récidives tout comme l’hygiène qui permettra d’éviter la gingivite initiale, la véritable porte d’entrée vers la parodontite. Il s’avère que la fibromyalgie initiale diminue fortement. Puis nous pratiquons à répétition la méthode de brossage et de désinfection qu’elle va reproduire au cabinet à chacune des visites. Même chose à 3 mois. Au quatrième mois, la myalgie générale (présente depuis plusieurs années) a complètement disparu.
Les détartrages dans un milieu parfaitement désinfecté commenceront 4 mois après le début de la thérapie, en démarrant par le cadran le plus touché. Le temps alloué permettra la reconstruction osseuse dans tous les défauts verticaux. Puis nous accorderons un dernier délai de 3 mois pour la cicatrisation complète dans ce milieu strictement commensal exempt de cellules inflammatoires.
Au 7è mois, la flore demeure similaire à ce qui a été observé à 1 mois : des coccis et des filaments, quelques co-agrégations. Il n’y a aucun globule blanc ni parasite. Les poches parodontales sont déjà relativement fermées à 80 %.
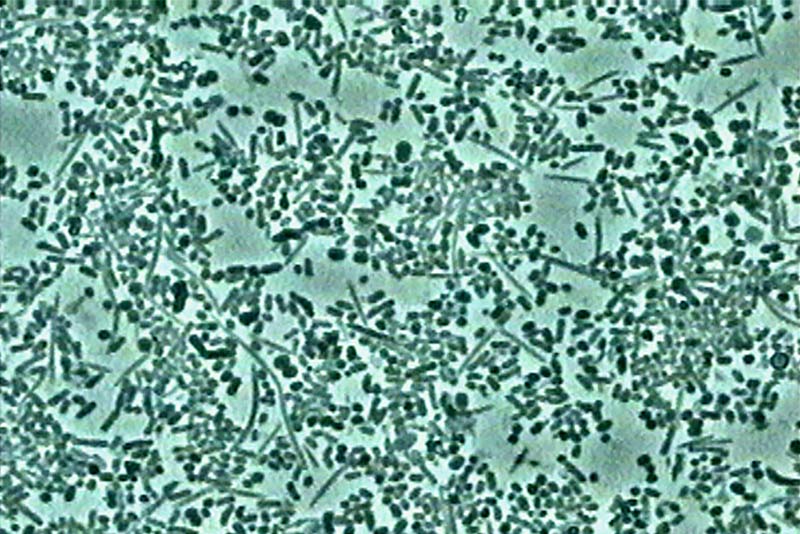
Fig. 06 : le biofilm, 7 mois après le début du traitement à 1000 x. La flore est toujours immobile, aucun globule blanc ou parasite.
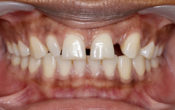
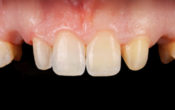
Après 12 mois de thérapie, l’index, au départ de 94mm est passé à 4mm. Il n’y a plus aucun signe de la maladie, pour aucune dent. Nous allons ensuite reconstituer l’apparence du sourire de la patiente avec des facettes de porcelaine afin de corriger la ligne du sourire, les chevauchements et les triangles noirs.
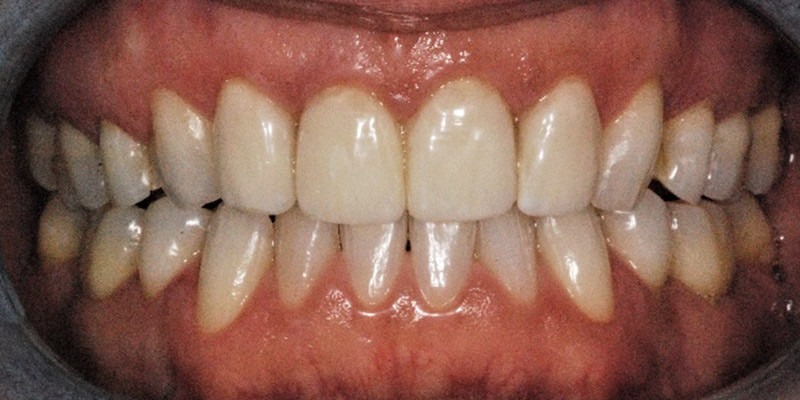
Fig. 07 : 2 ans après le début du traitement.
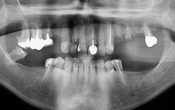
Les radiographies nous permettent de constater la croissance osseuse dans les défauts verticaux des dents 11-47-17-36-23 initialement à 8 et 9mm. Aucune intervention autre que la cicatrisation naturelle n’a été faite. C’est au rendez-vous de suivi, 24 mois après le début de la thérapie que nous pourrons déclarer la patiente parfaitement guérie.
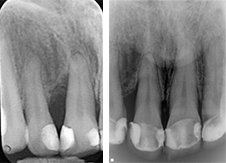
Fig. 08 : radiographie avant et après (à 0 et 24 mois de la thérapie).
Références bibliographiques
(1) Socransky S.-S., Haffajee A.-D. – Evidence of bacterial etiology: a historical perspective.
Periodontol 2000. 1994 ; 5 : 7-25.
(2) Lyons T., Sholten T., Palmer J.-C., Stanfield E. – Oral amebiasis: the role of Entamoeba gingivalis in periodontal disease.
Quintessence Int Dent Dig 1983 ; 14 (12) : 1245-8.
(3) Bonner M., Fresno M., Gironès N., Guillén N., Santi-Rocca J. – Reassessing the Role of Entamoeba gingivalis in Periodontitis.
Frontiers in Cellular and Infection Microbiology. 2018 ; 8.
(4) Bao X., Wiehe R., Dommisch H., Schaefer A.-S. – Entamoeba gingivalis Causes Oral Inflammation and Tissue Destruction.
J Dent Res. 2020; 99(5): 561-567.
(5) Ribeiro L.-C., Santos C., Benchimol M. – Is Trichomonas tenax a Parasite or a Commensal?
Protist. 2015 May ; 166 (2) : 196-210.
(6) Bourgeois D., Bouchard P., Mattout C. – Epidemiology of periodontal status in dentate adults in France, 2002-2003.
J Periodontal Res. 2007 Jun ; 42 (3) : 219-27.
(7) Bonner M., Amard V., Amiot M., Ihler S., Rochet J.-P., Verdy M. – Traitement antiparasitaire des maladies parodontales et péri-implantites : suivi multicentrique à 12 mois.
Actual. Odonto-Stomatol 2013 ; 261 : 22-28.