Les principes et applications du laser Erbium YAG en endodontie
Endodontie et micro-chirurgie, Lasers Par Cléa WAGNER, Romain GABRIEL, Alexia LARDERET le 22-07-2024La spécificité du laser Erbium YAG par rapport à d’autres lasers utilisés en dentisterie, est sa longueur d’onde appartenant à la famille de l’infrarouge (moyen), mesurée à 2 940 nm. Sa forte absorption dans l’eau (98%) et les composants aqueux des tissus mous lui confère une place importante lors des thérapies de conservation de la vitalité pulpaire, de traitements endodontiques ou lors de la reprise de traitement par voies orthogrades et a rétro.
Les thérapies assistées au laser s’acquittent de contact direct entre la fibre optique du laser sur les tissus ciblés. Les impulsions émises à l’extrémité de la pièce à la main du laser libèrent une onde lumineuse, qui en traversant le substrat irradié induira des effets photochimiques, photomécaniques et bactéricides.
(Re)découvrez dès maintenant l’introduction sur l’utilisation du laser en odontologie des Drs Cléa Wagner, Romain Gabriel et Alexia Larderet.
Conservation de la vitalité pulpaire : du coiffage direct à la pulpotomie assistée au laser
Lors du traitement des caries profondes, le laser Erbium YAG permet un curetage ciblé des tissus infectés. L’Erbium YAG, le laser Er,Cr:YSGG et le CO2 à émission pulsée sont les laser à privilégier sur les tissus durs tels que l’os et la dentine, dont le poids est composé de 70% de phase minérale (d’hydroxyapatite), de 20% de phase organique protéique et de 10% d’eau.
Grâce à son absorption dans l’eau et l’hydroxyapatite, l’Erbium YAG agit de manière sélective sur les tissus dentinaires, réduisant le risque de diffusion thermique vers les tissus sous-jacent : la pulpe.
Lorsque l’effraction pulpaire a eu lieu, la pulpotomie assistée au laser présente également plusieurs avantages(1). La composition du plasma du sang est majoritairement aqueuse, composée à 90% d’eau. L’absorption de l’onde lumineuse et sa conversion en chaleur au sein même du plasma est presque totale.
Dès lors que le laser atteint la surface du conjonctif pulpaire ciblé, la température atteint entre 50°C à 100°C, pendant une durée de l’ordre de la seconde, et produit une dessiccation, un blanchissement, et une rétraction des tissus par dénaturation des protéines et du collagène.
Afin d’éviter les dommages causés sur le parenchyme pulpaire immédiatement à proximité de la pulpe inflammée, le laser s’utilise en mode « sub-ablatif » et délivre une onde lumineuse à basse puissance (≤ 0,5W). La forte absorption de l’onde lumineuse dans l’eau, dès les premiers micromètres de tissu pulpaire irradié, prévient des risques iatrogènes de diffusion en profondeur sur la pulpe saine et sur les tissus adjacents.
Au sein de la pulpe inflammée et irradiée au laser, la contraction des vaisseaux sanguins initie l’hémostase primaire. Lorsque l’intégralité de la pulpe inflammée est éliminée, la coagulation et le processus de cicatrisation peuvent avoir lieu. Dans d’autres cas, la compression d’une boulette de coton stérile est nécessaire pour évaluer le statut inflammatoire du tissu pulpaire résiduel et du parenchyme pulpaire sous-jacent.
L’utilisation du laser à distance des tissus organiques, sous un spray d’eau stérile en continu, augmente la visibilité et le confort de l’opérateur. De plus, la fine pellicule d’eau délivrée à la surface des tissus irradiés réduit l’élévation de la température in situ. L’absence de contact direct entre la fibre et les tissus organiques garantit le respect et le maintien des règles d’asepsie per-opératoires.
Secondairement à la dénaturation et la rétractation des tissus irradiés, une couche superficielle de coagulation apparaît et s’en su
it la nécrose et la détersion des tissus. Cette étape de destruction tissulaire marque le début de la phase de cicatrisation(2).
Cas clinique
Patient adressé pour des symptômes de pulpite réversible associés à une résorption inflammatoire externe cervicale envahissante. Une inflammation gingivale localisée sur la gencive marginale, modérée à sévère, est visible à l’examen clinique.
Le patient a auparavant consulté son dentiste qui a réalisé le curetage de la zone résorbée et mise en place un ciment verre ionomère. Aucun traitement endodontique n’a été initié. Le patient se plaint de douleurs provoquées par les sensations thermiques.
Une adjonction de composite fluide (sans mordançage) en proximal de la dent 22 a été réalisée par le Dr Romain Gabriel en prévision de la future intervention chirurgicale.
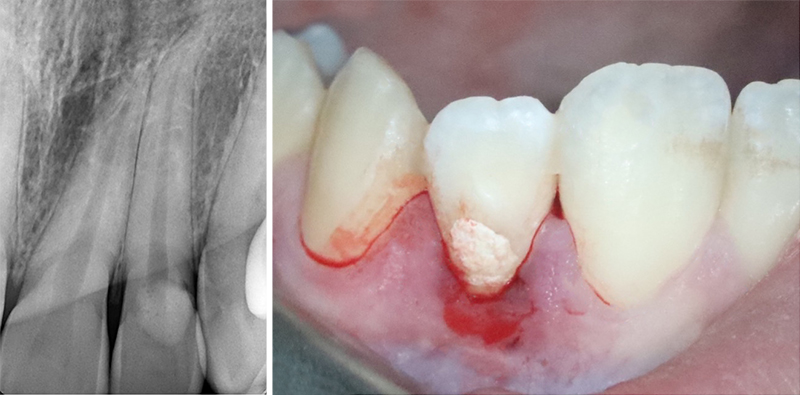
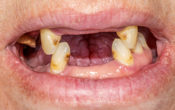
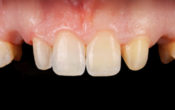
Fig. 01 : radiographie rétro alvéolaire et photo pré-opératoire de la 22.

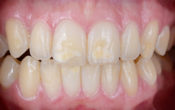
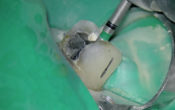
Fig. 02 : photos per opératoires de la pulpotomie assistée au laser Erbium YAG. Irradiation à distance des tissus pulpaires, sous un spray d’eau stérile en continu pour augmenter la visibilité et réduire l’échauffement du parenchyme pulpaire sous-jacent. La pulpotomie a été conduite jusqu’à un niveau situé apicalement par rapport à la limite radiculaire de la zone résorbée.
Photo de droite : hémostase primaire obtenue sans avoir recours à une compression manuelle.

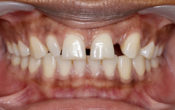
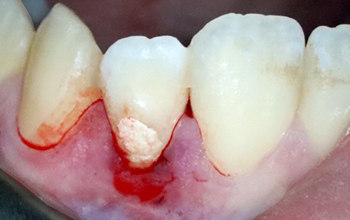
Fig. 03 : photo per opératoire du coiffage direct de la pulpe à l’aide de ciments silicate di/tri calciques : Total Fill Fast Set Putty (FKG). Permet d’optimiser le scellement endodontique, avec des propriétés antibactériennes, une adhérence aux parois dentinaires et un pH de 12,4 avec la libération d’OH2Ca à distance.
Chirurgie endodontique
Lors de traitements chirurgicaux assistés au laser, l’effet photoablatif est conditionné par l’énergie transmise et la fréquence à laquelle les impulsions laser sont distribuées. Au-delà de 150 mJ, l’exérèse des tissus mous inflammatoires et granulomateux est observable avec des lasers émettant dans l’infrarouge comme le laser Erbium-YAG (2,9 µm).
En effet, 2.9 µm est situé au niveau du pic d’absorption de l’eau. A une fréquence faible, l’absorption de l’énergie par l’eau tissulaire est si intense que l’eau in situ s’évapore instantanément sous l’impulsion laser et provoque l’effet ablatif des tissus. En outre, la très brève durée du pulse (quelques centaines de micro secondes) évite les phénomènes de diffusion thermique.
En plus d’un curetage sélectif des tissus mous, un effet de cautérisation en superficie des tissus ciblés initie l’hémostase primaire et augmente la visibilité de l’opérateur. L’efficacité et la précision de coupe au sein des différentes couches tissulaires est observable sous aide optique.
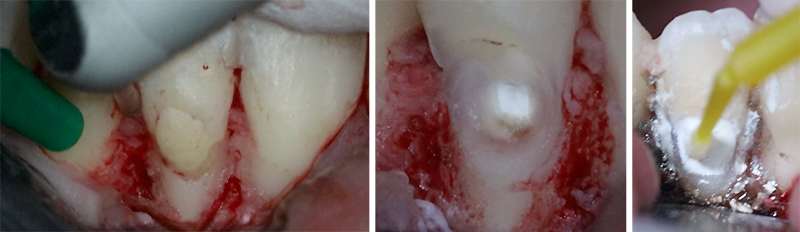
Fig. 04 : photo per opératoires de la phase chirurgicale du traitement de la résorption externe cervicale. Élimination du tissu de granulation au laser. Dépose de la restauration existante et curetage des tissus dentinaires résorbés. Visibilité du ciment biocéramique mis en place lors de la phase endodontique. Adjonction de ciment silicate di/tricalciques en fond de cavité. Ajout d’un ciment verre ionomère chargé en surface « technique sandwich fermé ».

Fig. 05 : chanfrein réalisé par le Dr Romain Gabriel en périphérie de la cavité.
Puis réalisation du polissage et sutures en points suspendues aux les plots de composite proximaux.
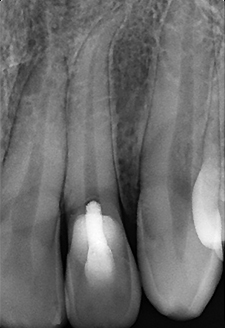
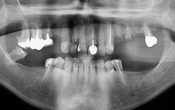
Fig. 06 : radiographie rétro alvéolaire post opératoire à 6 mois. Les examens cliniques et radiographiques ne mettent pas de signe d’inflammation pulpaires ou péri apicaux en évidence. Un pont de tissu minéralisé est visible en regard du ciment biocéramique. Le patient ressent des sensations thermiques physiologiques légèrement diminuées, sans symptômes associés.
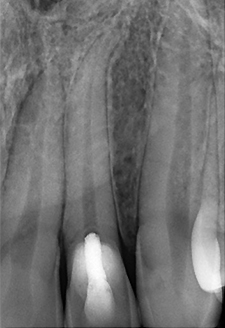
Fig. 07 : radiographie rétro alvéolaire post opératoire à + 12 mois. Les examens cliniques et radiographiques ne mettent pas de signe d’inflammation pulpaires ou péri apicaux en évidence. Un pont de tissu minéralisé est visible en regard du ciment biocéramique.
Traitements endodontiques orthogrades : l’activation des solutions d’irrigation assistée au laser
En comparaison aux autres lasers classés dans la famille de l’infrarouge moyen, l’effet de cavitation produit par la fibre du laser Erbium YAG immergée dans la cavité d’accès remplie de solution d’irrigation est sans précédent.
Le laser Erbium YAG s’inscrit donc parfaitement dans nos principes actuels de traitements mini-invasifs, comme moyen d’activation de nos solutions d’irrigation.
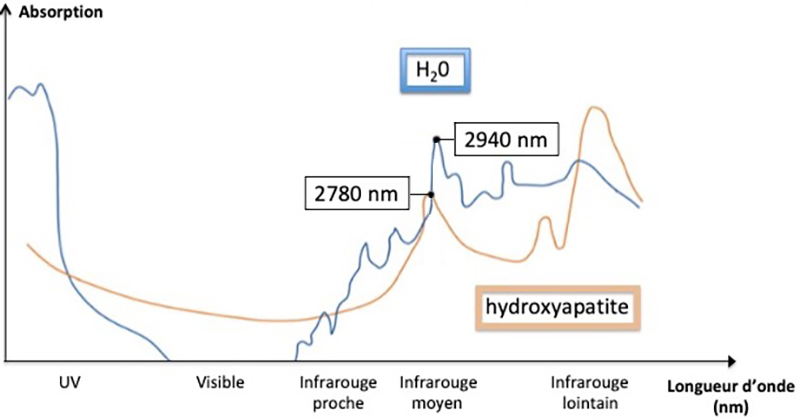
Fig. 08 : spectre élétromagnétique.
La faible énergie (< 40mJ) transmise par l’onde lumineuse collimatée induit une élévation de température ponctuelle, de la solution aqueuse irradiée. Chaque pulsation laser produit alors une bulle de vapeur appendue à la fibre optique, qui s’expand dans les trois dimensions jusqu’à se rompre sous la pression du liquide environnant. Lors de son collapsus, la bulle de vapeur se détache de la fibre optique pour progresser axialement au sein de l’endodonte. L’implosion de la bulle de cavitation sera à l’origine d’autres phénomènes de cavitations secondaires, à distance de la cavité d’accès, c’est l’effet photoacoustique.
L’effet du laser sur l’hypochlorite a été étudié et la dynamique des fluides qui en résulte est comparable à l’effet photoacoustique sur les solutions aqueuses(3,4). Lors d’une activation d’hypochlorite au laser, les propriétés solvantes et antibactériennes de la solution garantissent la désinfection et le cathétérisme de système endo-canalaire(5).
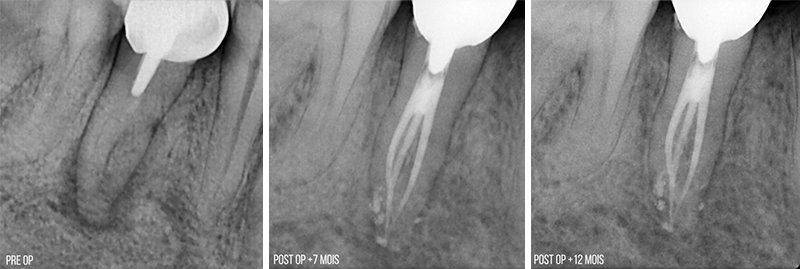
Fig. 08 : radiographies pre et post opératoires de la 45 à +7 mois et à + 12 mois post opératoire. Patient adressé pour des symptômes d’abcès apical aigu.
Traitement endodontique réalisé par le Dr Romain GABRIEL : activation des solutions d’hypochlorite et d’EDTA au laser Erbium YAG. Rinçage final activé au laser Erbium YAG et obturation intra canalaire au ciment biocéramique.
Les ondes de choc pulsatiles et les phénomènes hydrodynamiques produisent des contraintes mécaniques de cisaillement sur les surfaces canalaires efficaces pour l’élimination de la boue dentinaire des parois canalaires(6,7).
L’effet bactéricide du laser repose sur ses effets photoacoustiques et photochimiques au sein même de la solution d’irrigation(8).
Le phénomène de diffusion prédomine lors de la pénétration de la solution d’irrigation au sein de la dentine canalaire infectée. La propagation et les mouvements de fluides initiés par l’irradiation laser induisent un gradient de concentration de la solution d’hypochlorite dans le canal principal par rapport au tubulis dentinaires(9).
L’exposition prolongée et la meilleure pénétration de l’hypochlorite de sodium en profondeur au sein des tubulis dentinaires potentialisent l’effet bactéricide de la solution d’irrigation.
On observe une meilleure efficacité de l’hypochlorite sur les bactéries intra tubulaires par rapport à d’autres moyen d’activation des solutions d’irrigation. Cette pénétration s’étend de la chambre pulpaire au réseau canalaire, isthmes, deltas apicaux et tubulis dentinaires. Il a été démontré que l’effet de cavitation produit pourrait permettre la destruction des bactéries à des profondeurs dentinaires comprises entre 300 à 400 µm(10).
En parallèle, le laser est à l’origine d’effets chimiques extemporanés au sein de la solution d’hypochlorite, c’est l’effet photochimique. Il intervient tel un catalyseur du taux de réaction du NaClO en solution augmentant le taux de chlorine, acteur majeur de la dissolution des composants organiques(11). Il est important de souligner que grâce à cette approche, le risque d’extrusion est diminué(12).
Conclusion
En endodontie, le laser Er:YAG est un atout très complet pour les traitements endodontiques orthogrades, grâce à l’activation des solutions d’irrigation assistée au laser. Il permet également la désinfection à distance des tissus pulpaires dans le cadre d’un coiffage direct, tout en réduisant l’échauffement du parenchyme pulpaire sous-jacent.
Afin de compléter cette présentation, les Drs Cléa Wagner, Romain Gabriel et Alexia Larderet ont publié un article sur la chirurgie des tissus mous au laser Er:YAG.
Références bibliographiques
(1) D. Ricucci, S. Loghin, and J-F. Siqueira Jr – Correlation between clinical and histologic pulp diagnoses.
J Endod, vol. 40, no. 12, pp. 1932–1939, 2014, doi: 10.1016/j.joen.2014.08.010
(2) T. Komabayashi, A. Ebihara, and A. Aoki – The use of lasers for direct pulp capping.
J Oral Sci, vol. 57, no. 4, pp. 277–286, 2015, doi: 10.2334/josnusd.57.277
(3) J. D. Pecora, A. Brugnera, A. L. Cussioli, F. Zanin, and R. Silva – Evaluation of dentin root canal permeability after instrumentation and Er:YAG laser application.
Lasers Surg Med, vol. 26, no. 3, pp. 277–281, 2000, doi: 10.1002/(SICI)1096-9101(2000)26:3<277:AID-LSM5>3.0.CO;2-M
(4) X. Cheng et al – Evaluation of the bactericidal effect of Nd:YAG, Er:YAG, Er,Cr:YSGG laser radiation, and antimicrobial photodynamic therapy (aPDT) in experimentally infected root canals.
Lasers Surg Med, vol. 44, no. 10, pp. 824–831, Dec. 2012, doi: 10.1002/lsm.22092
(5) J. Blanken, R. De Moor, and M. Meire – Laser Induced Explosive Vapor and Cavitation Resulting in Effective Irrigation of the Root Canal . Part 1 : A Visualization Study.
Laser in Surgery and Medicine, vol. 41, no. 7, pp. 514–9, 2009, doi: 10.1002/lsm.20798
(6) C-E. Brennen – Cavitation and Bubble Dynamics.
1995. Accessed: Nov. 29, 2018.
(7) E. DiVito, O-A. Peters, and G. Olivi – Effectiveness of the erbium: YAG laser and new design radial and stripped tips in removing the smear layer after root canal instrumentation.
Lasers Med Sci, vol. 27, pp. 273–280, 2012, doi: 10.1007/s10103-010-0858-x
(8) M-A. Meire, K. De Prijck, T. Coenye, H. J. Nelis, and R. De Moor – Effectiveness of different laser systems to kill Enterococcus faecalis in aqueous suspension and in an infected tooth model.
Int Endod J, vol. 42, no. 4, pp. 351–359, 2009, doi: 10.1111/j.1365-2591.2008.01532.x
(9) H. Matsumoto, Y. Yoshimine, and A. Akamine – Visualization of irrigant flow and cavitation induced by Er:YAG laser within a root canal model.
J Endod, vol. 37, no. 6, pp. 839–843, 2011, doi: 10.1016/j.joen.2011.02.035
(10) A-A. Azim, H. Aksel, T. Zhuang, T. Mashtare, J-P. Babu, and G-T-J. Huang – Efficacy of 4 irrigation protocols in killing bacteria colonized in dentinal tubules examined by a novel confocal laser scanning microscope analysis.
J Endod, vol. 42, no. 6, pp. 928–934, 2016, doi: 10.1016/j.joen.2016.03.009
(11) R-G. Macedo, P. Wesselink, F. Zaccheo, D. Fanali, and L. Van Der Sluis – Reaction rate of NaOCl in contact with bovine dentine: Effect of activation, exposure time, concentration and pH.
Int Endod J, vol. 43, no. 12, pp. 1108–1115, 2010, doi: 10.1111/j.1365-2591.2010.01785.x
(12) H-H. Peeters and L. Mooduto – Radiographic examination of apical extrusion of root canal irrigants during cavitation induced by Er,Cr:YSGG laser irradiation: An in vivo study.
Clinical Oral Investigations, vol. 17, no. 9, pp. 2105–2112, 2013, doi: 10.1007/s00784-012-0910-2