Nouvel épisode de la série « Les Tutos Paro »
Épisode #02 / Le diagnostic des maladies parodontales
S’il est rose saumon, fermement festonné autour des dents et avec une profondeur de sulcus < 4mm, nous avons un parodonte en bonne santé. Et celui-ci fera barrière entre le milieu extérieur buccal et le milieu intérieur du corps humain.
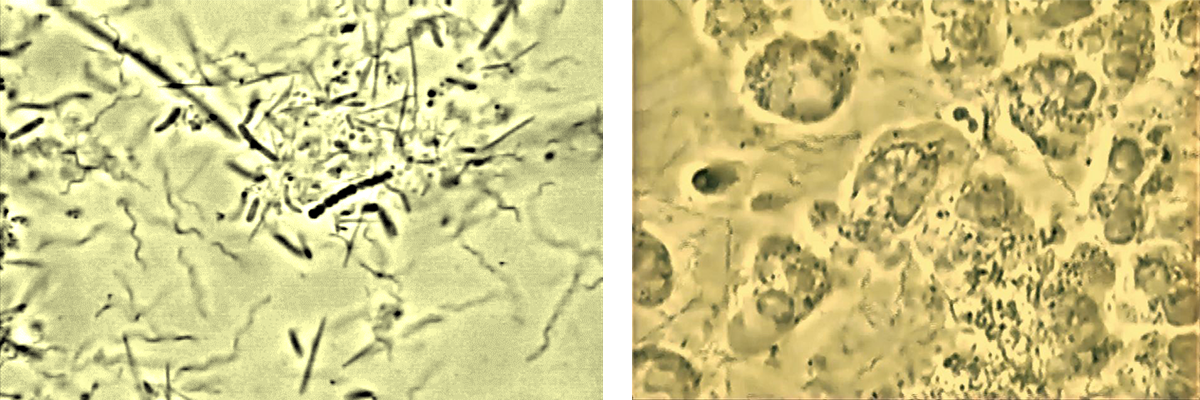
Deux grands types de maladies parodontales existent, dont la principale étiologie est la présence d’une quantité excessive de plaque dentaire et/ou d’un microbiote parodontal pathogène (dysbiose).
Le premier signe d’appel/d’alerte d’une gingivite ou d’une parodontite est le saignement gingival spontané ou provoqué.
Le diagnostic de la gingivite(1-2) repose sur l’interrogatoire du patient qui évoque souvent ces saignements gingivaux, la présence d’un goût métallique, un changement de l’aspect des gencives, parfois une douleur ou une gêne qui entraîne une difficulté à s’alimenter et à se brosser les dents.
A l’examen clinique on observe un changement de couleur : la gencive habituellement rose saumon devient rouge ; et un œdème : la gencive est tuméfiée, sa forme habituelle est changée avec une possible altération du festonnage gingival, son aspect est lisse et brillant.
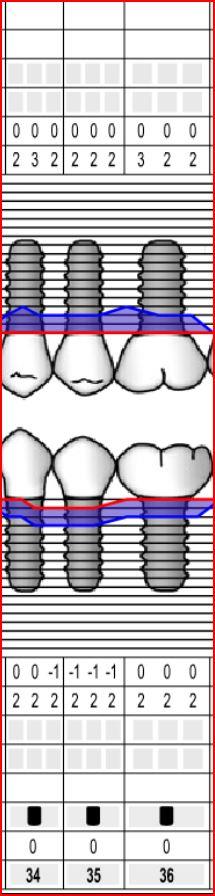
Lors de l’insertion de la sonde parodontale, la profondeur mesurée correspond au sillon gingivo-dentaire et est inférieure ou égale à 3mm. (En présence d’un œdème gingival important, les valeurs de sondage peuvent être augmentées sans perte d’attache associée : on parle alors de poche gingivale ou de pseudo-poche.)
Cette maladie est réversible à condition de la prendre en charge.
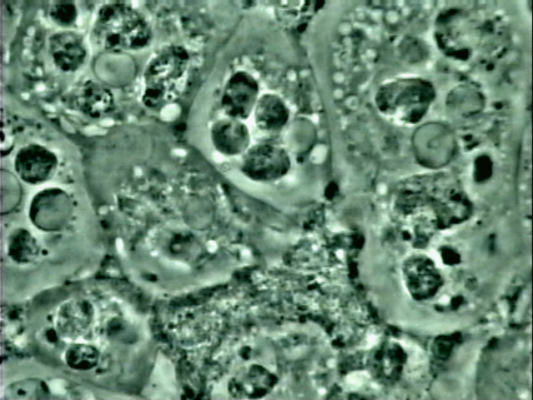
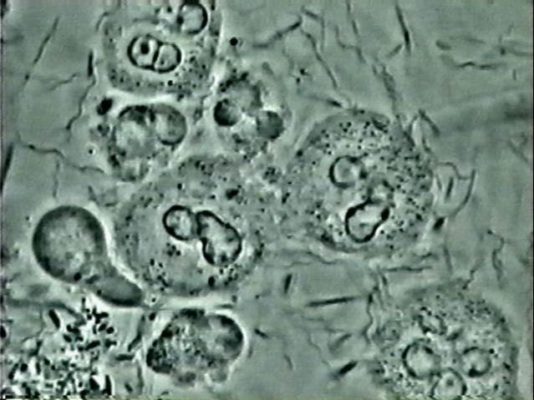
Chez certains patients, si la gingivite n’est pas prise en charge et qu’elle est aggravée par d’autres facteurs, un processus de destruction plus profond s’installe. C’est la parodontite qui affecte l’os alvéolaire, le cément et le ligament parodontal. Cette destruction est irréversible et inexorable en l’absence de traitement.
En présence de parodontite(3), à l’interrogatoire, le patient dit que ses dents commencent à bouger, à changer de place, qu’elles paraissent plus « longues ». Il décrit des difficultés à s’alimenter et à pratiquer des manœuvres d’hygiène. Il a conscience de sa mauvaise haleine. Cela a une répercussion sur la qualité de vie du patient en termes de fonction (manger, parler, sourire), d’esthétique et de confiance en soi.
A l’examen clinique on observe souvent, en plus des symptômes de la gingivite, des dénudations radiculaires consécutives aux récessions gingivales, une hypersensibilité au chaud et au froid, des déplacements dentaires et des douleurs (même si ce signe est très peu fréquent).
Le sondage parodontal mettra en évidence des valeurs supérieures à 4 mm. Ces poches parodontales, signe de la perte d’attache, représentent une zone où une plus grande quantité de bactéries peut continuer à s’accumuler, menaçant ainsi la survie des dents et la santé générale (comme nous l’avons vu lors du précédent épisode). L’examen clinique sera alors complété par un examen radiologique pour évaluer l’alvéolyse.
Depuis 2018, les parodontites sont classées en 4 stades et 3 grades(4) :
• Le stade (I à IV) de la parodontite est défini en fonction de la gravité (principalement l’atteinte parodontale en référence à la longueur de la racine et la perte de dents causée par la parodontite), et de la complexité de la prise en charge (profondeur de la poche, défauts infra-osseux, atteinte inter-radiculaire, hypermobilité de la dent, dysfonctionnement masticatoire). Leur étendue localisée ou généralisée est précisée.
• Le grade de la parodontite est basé sur des preuves directes ou indirectes de la vitesse de progression: lente, modérée et rapide (grade A-B-C). L’analyse des facteurs de risque tels que le tabac ou le diabète est utilisée comme modificateur du grade.
Au final que retenir ?
• La santé parodontale est facile à identifier car bien définie cliniquement,
• La douleur n’est pas le signal d’alarme ni d’une gingivite ni d’une parodontite « hélas »,
• Le saignement au sondage est le signe d’alerte d’une inflammation parodontale,
• Les lésions de la gingivite sont réversibles,
• Les lésions de la parodontite peuvent laisser des séquelles irréversibles,
• Plus tôt le diagnostic est fait plus les chances de conserver les dents du patient sont grandes.
Notre rôle « primordial » :
• Dépister les maladies parodontales à leur stade le plus précoce. « On ne trouve que ce qu’on cherche » !
• Prévenir l’évolution des maladies parodontales pour préserver le capital parodontal et dentaire de nos patients
• Prescrire des facteurs protecteurs efficaces :
– Les instruments d’hygiène parodontale comme une brosse à dents dont les poils sont très souples, et des brossettes inter dentaires.
– Les dentifrices qui permettent d’éliminer le biofilm bactérien tout en respectant les tissus bucco-dentaires et parodontaux.
• Mettre en place une thérapeutique parodontale et un suivi des changements comportementaux.
En conclusion
Des moyens de diagnostic simples et efficaces sont à la portée de nous tous : une écoute attentive, un regard curieux et une sonde parodontale graduée pour commencer.
Nous ne pouvons pas passer à côté du diagnostic d’une maladie parodontale !
Nous verrons dans un prochain épisode comment soigner ces maladies parodontales pour le plus grand bénéfice de nos patients.
Bibliographie
(1) Chapple I.L.C., Mealey B.L., Van Dyke T.E., Bartold P.M., Dommisch H., Eickholz P., Geisinger M.L., Genco R.J., Glogauer M., Goldstein M., Griffin T.J., Holmstrup P., Johnson G.K., Kapila Y., Lang N.P., Meyle J., Murakami S., Plemons J., Romito G.A., Shapira L., Tatakis D.N., Teughels W., Trombelli L., Walter C., Wimmer G., Xenoudi P., Yoshie H. Periodontal health and gingival diseases and conditions on an intact and a reduced periodontium: Consensus report of workgroup 1 of the 2017 World Workshop on the Classification of Periodontal and Peri-Implant Diseases and Conditions. J. Clin Periodontol. 2018 Jun;45 Suppl 20:S68-S77.
(2) Murakami S., Mealey B.L., Mariotti A., Chapple I.L.C. Dental plaque-induced gingival conditions. J Periodontol. 2018 Jun;89 Suppl 1:S17-S27.
(3) Papapanou P.N., Sanz M., Buduneli N., Dietrich T., Feres M., Fine D.H., Flemmig T.F., Garcia R., Giannobile W.V., Graziani F., Greenwell H., Herrera D., Kao R.T., Kebschull M., Kinane D.F., Kirkwood K.L., Kocher T., Kornman K.S., Kumar P.S., Loos B.G., Machtei E., Meng H., Mombelli A., Needleman I., Offenbacher S., Seymour G.J., Teles R., Tonetti M.S. Periodontitis: Consensus report of workgroup 2 of the 2017 World Workshop on the Classification of Periodontal and Peri-Implant Diseases and Conditions. J Clin Periodontol. 2018 Jun;45 Suppl 20:S162-S170.
(4) Tonetti M.S., Greenwell H., Kornman K.S. Staging and grading of periodontitis: Framework and proposal of a new classification and case definition. J Periodontol. 2018 Jun;89 Suppl 1:S159-S172.
Cette vidéo a été réalisée avec le soutien de U.labs (Parogencyl), partenaire de la SFPIO.
![]()